Hvor mutasjoner feiler
(fra 'Theistic Evolution - a Scientific, Philosophical and Theological critique, kap.7)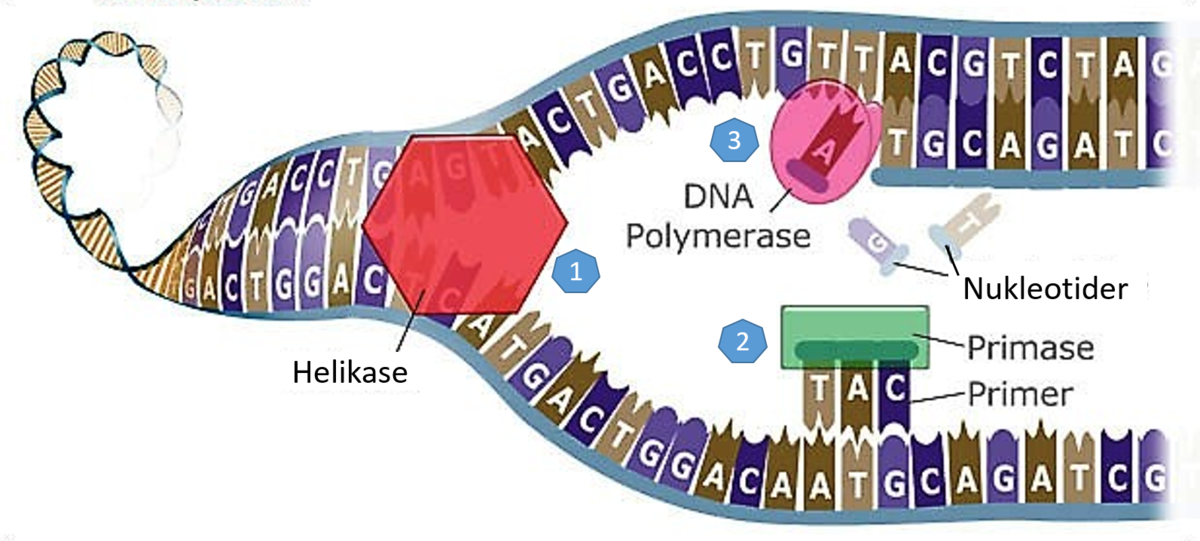
I. A. Sentraldogmet i neo-darwinismen
Da Watson og Crick publiserte sin modell for kjemisk struktur til DNA i 1953 bemerket de at modellen "foreslår en mulig kopieringsmekanisme for det genetiske materialet." Etter en måned hadde de konkretisert det til: "Vår modell for deoxyribonucleid-syre, er .. et par av maler, der hver utgjør den komplementære del til den andre. Vi forestiller oss at forut for duplisering .. nøstes de to malen opp og skiller lag. Så fungerer hver kjede som mal for å danne en ny komplementær del til seg selv, så at til slutt vil vi ha to par av kjeder -- der vi før bare hadde én. Sekvensen i baseparene vil ha blitt nøyaktig kopiert." (9) Denne hypotesen ble senere bekreftet av biologene M. Meselson og Fr. Stahl som publiserte eksperimentelle bevis for at DNA molekyler dupliserte seg akkurat som Watson og Crick foreslo.
I 1955 oppdaget den rumenske biologen G. Palade mikroskopise partikler i cellen som senere ble kalt ribosomer. Pallade og andre viste deretter at ribosomer var stedet der proteiner ble dannet i celler. I 1956 oppdaget E. Volkin og L. Asrachan det de kalte "DNA-like" ribonukleotider (RNA), som tjente i en formidlerrolle (budbringer /messenger-RNA) mellom DNA og protein-syntese. (12)
I 1958 foreslo Fr. Crick at spesifisiteten i DNA-sekvensen ligger bare i nukleotid-sekvensen dens, som så koder en tilsvarende sekvens av budbringer RNA, som i sin tur igjen opererer som mal for aminosyre-sekvensen til et protein. Crick foreslo at informasjonen i DNA-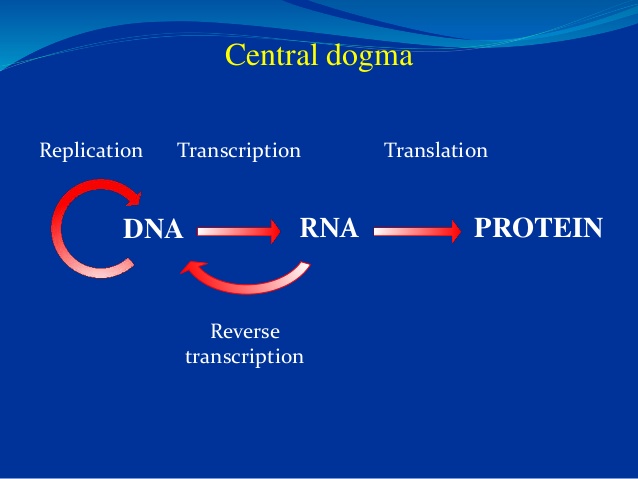 sekvenser kan bli overført fra DNA til protein, men ikke tilbake igjen. --Senere kalt for sentraldogmet i molekylær biologi.
sekvenser kan bli overført fra DNA til protein, men ikke tilbake igjen. --Senere kalt for sentraldogmet i molekylær biologi.
Det ovenstående har fått mange folk til å tro at DNA dermed besitter et 'genetisk program'som spesifiserer de prinsipielle trekkene ved en organisme. James Watson skrev i en college lærebok (1987) at "vi vet at instruksjonene for hvordan egget utvikler seg til en voksen er skrevet i den lineære base-sekvensen langs DNA-et." (15) Biolog Fr. Collins skrev i 2006 at vårt DNA er et "forbløffende script, som bærer i seg alle instruksjonene for å bygge et menneske." (16) Enkelt sagt innebærer sentraldogmet at "DNA lager RNA, som lager proteiner, som lager oss."
Det har vært mange kritikere av sentraldogmet. En prominent kritiker biologisk-historiker Ev. Fox Keller skrev i 2000: --Informasjonsinnholdet i DNA forblir essensielt --uten da kan ikke utvikling (livet selv) fortsette. Men nåværende forskning, i et antall biologiske disipliner, har begynt å legge betydelig press på biologer til å rekonseptualisere programmet for utvikling som noe betydelig mer komplekst enn ett sett instruksjoner skrevet i 'nukleotid-alfabetet'. (17)
Likevel har sentraldogmet blitt veldig populært. En grunn er at det er konsistent med neo-darwinistisk teori. Som Jacques Monod én gang sa, med sentraldogmet "og [med] forståelsen av den tilfeldig fysiske basis for mutasjoner som molekylærbiologien også har forsynt, er mekanismen i darwinismen endelig sikkert grunnfestet. Og mennesket må forstå at han er bare et ulykkestilfelle." (18)
B. Epigenetikk
Likevel vet alle biologer, også de som tror på det sentrale dogmet, at stien fra genotype til fenotype er berørt av andre faktorer. Det greske 'epi' har bl.a. betydningene 'over', 'i tillegg til' . . I 1942 fremmet den britiske biologen C. Waddington at termen 'epigenetikk' innebar studiet av "prosessene involver i mekanismen som gener i genotypen frembringer fenotype endringer i gjennom." (19) Men tre år 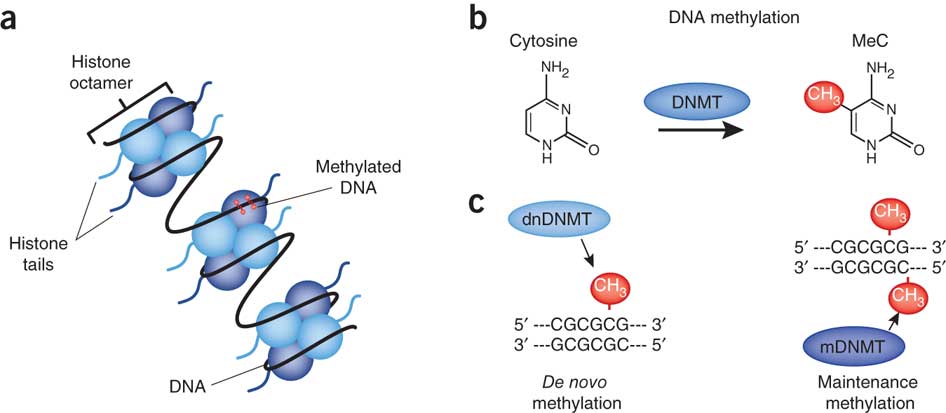 tidligere hadde Waddington benyttet termen 'epigenotype' for mer bredt å referere til "settet av organisatører og organiserende relasjoner som et spesifikt vevstykke vil bli gjenstand for, gjennom sin utvikling." (20) Så epigenetikk har hatt ulike betydninger siden starten. I en snever betydning referer det til mekanismene som DNA produserer fenotype effekter gjennom. I en bredere betydning, refererer det til alle faktorer involvert i utviklingen, der DNA er én.
tidligere hadde Waddington benyttet termen 'epigenotype' for mer bredt å referere til "settet av organisatører og organiserende relasjoner som et spesifikt vevstykke vil bli gjenstand for, gjennom sin utvikling." (20) Så epigenetikk har hatt ulike betydninger siden starten. I en snever betydning referer det til mekanismene som DNA produserer fenotype effekter gjennom. I en bredere betydning, refererer det til alle faktorer involvert i utviklingen, der DNA er én.
De fleste biologer benytter nå epigenetikk i en smal betydning, for å referere til arvelige endringer i et kromosom som ikke endrer DNA-sekvensen. I 2007 skrev biolog J. Keefer: "Epigenetikk er studiet av arvelige endringer i gen funksjoner som inntreffer uavhengig av endringer i primære DNA-sekvenser. De best studerte endringene er DNA metylering og endringer i kromatin strukturer ved histon modifikasjon, og histon utveksling." (21)
I DNA metylering, knytter en metylgruppe som består av et karbon-atom og tre hydrogenatomer kjemisk til en base i DNA og påvirker derved hvorvidt det strekket av DNA blir transkribert. Kromatin er kombinasjon av DNA og proteiner, som utgjør et kromosom, og de viktigste proteinene kalles histoner. Histoner komprimerer det lange DNA-molekylet ved å tjene som spoler, som DNA da vinder seg rundt. Flere ulike molekyler kan modifisere histoner ved å binde seg kjemisk til dem, for derved å endre kromosom struktur og påvirke DNA-transkribering. Videre er det flere slags histoner med ulike egenskaper og molekylære 'anstander' kan bytte ut noen med andre.
DNA metylering, histon modifikasjon og histon utveksling hjelper å bestemme når og hvor spesifikke DNA-sekvenser blir transkribert til RNA. Men epigenetikk i denne snevre betydning lar sentral-dogmet forbli intakt. Imidlertid fortsetter noen biologer å forstå epigenetikk i en mer bred betydning. I 1993 skrev S. Herrring: "Vidt sett refererer epigenetikk til hele serien av interaksjoner blant celler og celleprodukter" som fører til embryo-utvikling. (22) I 2002 skrev E. Jablonka og M. Lamb at epigenetikk "hovedsakelig er beskjeftiget med mekanismene hvorved cellene blir knyttet til en spesifikk form eller funksjon." De konkluderte " Ved å gjenkjenne at det er epigenetiske arvelige systemer, gjennom hvilke ikke-DNA variasjoner kan bli overført i celle og organisme-avstamning, utvider arv-begrepet og utfordrer den bredt aksepterte gen-sentrerte neo-darwinistiske versjon av darwinismen. Den bredere versjon av epigenetikk impliserer at det er lag av informasjon som er uavhengig av DNA, og det er det virkelig.
II. Hvorfor sentraldogmet feiler
I følge sentraldogmet spesifiserer DNA messenger-RNA, som igjen spesifiserer proteiner, som igjen spesifiserer organismen. Likevel er mange messenger(m)-RNA ikke fullstendig spesifisert ved DNA-sekvenser og mange proteiner er ikke fullstendig spesifisert ved messenger-RNA.
A. DNA spesifiserer ikke mange RNA
Etter en DNA sekvens er transkribert til RNA, kan flere prosesser modifisere RNA'et slik at det ikke matcher det originale transskriptet. To godt studerte prosesser er RNA-spleising og RNA-editering.
1. RNA-spleising
I plante og dyreceller, er de fleste DNA-sekvenser som koder for proteiner avbrutt av DNA-strekk som ikke koder for noe protein. Førstnevnte kalles eksoner og sistnevnte kalles for introner. Når DNA blir transkribert, vil eksoner og introner inkluderes i messenger-RNA som vil tjene som mal for protein, men intronene blir så utelatt og eksonene blir spleiset tilbake sammen. Men én eller flere av eksonene kan bli utelatt eller ødelagt, så det endelige messenger-RNA har en sekvens som ikke lenger svarer til den opprinnelige DNA-sekvensen. Dette kalles alternativ spleising og med det kan celler lage tusenvis av flere m-RNA og proteiner enn det som er kodet i DNA-sekvensen. Én DNA-sekvens hos bananfluer genererer flere enn 18 tusen ulike proteiner gjennom alternativ spleising. (24)
I 2010 rapporterte et team av molekylær-biologer at m-RNA transkripter " fra omtrent 95% av multi-ekson menneskelige gener, blir spleiset på mer enn én måte. Og i de fleste tilfeller ble de resulterende transkriptene ulikt uttrykt innen forskjellige celler og vevstyper." (25) Forskjellen som produseres ved alternativ spleising har funksjonelle konsekvenser. Bl.a. regulerer ulike spleisinger fysiologiske endringer og nerve-utvikling, og det produserer enorm ulikhet i membran-proteiner.
2. RNA-editering
I tillegg til alternativ spleising kan mange dyre-transkripter gjennomgå RNA-editering, som kan modifisere eksisterende nukleotider eller sette noen i tillegg. Editering av ett m-RNA kan påvirke aminosyre-sekvensen for proteinet det koder for, slik at proteiner skiller seg fra det som DNA spesifiserte. Nylige studier har avdekket omfattende RNA-editering i mennesker. (26) RNA-editering, i likhet med RNA-spleising, har funksjonelle konsekvenser. Det er vidt utbredt i dyrs nervesystemer, der det modifiserer m-RNA i proteiner, involvert i dyre-signalering. I mus, er RNA editering nødvendig for overlevelse av stam-celler som genererer modne blod-celler. En har tilfeller av funksjonell editering av RNA i blekksprutarter, slik at de bedre kan tilpasses sitt miljø (kulde/farge-tilpasninger etc)
 B. m-RNA spesifiserer ikke endelig form for mange proteiner
B. m-RNA spesifiserer ikke endelig form for mange proteiner
Funksjonen til et protein-molekyl avhenger av dets tre-dimensjonale form, som bestemmer av hvordan det lineære molekylet folder seg sammen. Selv om amino-syre sekvensen ofte bestemmer foldingen, skjer det ikke alltid. Mange faktorer i cellen, f.eks. grad av molekylær-tetthet i cellen kan påvirke hvordan proteinet folder seg. Noen proteiner adopterer like foldings-former, til tross for ulike aminosyre-sekvenser. (28) Andre antar ulike foldinger, til tross for identiske eller nesten like aminosyre-sekvenser. Ett velkjent eks. på det siste er prioner, som misformede proteiner, som er sykdomsfremkallende og arvelige. Men det er også ikke-sykdomsfremkallende proteiner, der samme aminosyre-sekvens kan foldes i mer enn en form. Disse kalles 'metamorfe' proteiner. (29)
Noen proteiner er i seg selv uordnede. Ca. 20-30% av proteiner i pattedyr-celler er uten iboende ordnet 3-dimensjonal struktur. De adopterer foldede strukturer bare etter samvirke med andre molekyler. (30) Iboende uordnede proteiner spiller viktige roller i å regulere membran-kanaler og tjener som nav i intracellulære nettverk.
C. De fleste proteiner er modifisert ved glykolsylasjon
Endelig er de fleste plante og dyre - celler kjemisk modifisert etter oversettelse, ved en prosess som kalles 'glykolsylasjon' (se f.eks. https://www.agilent.com/cs/library/packageinsert/public/117311001.PDF ) som involverer tilførsel av 'glykaner'. Glykaner (av et gresk ord for søtsaker) er sammensatt av mange små sukkerformer, kjemisk bundet til hverandre, og de kan være ekstremt komplekse. I levende celler er nukleotidene i DNA linket til hverandre i lineære kjeder (med få unntak), det samme gjelder aminosyrer i proteiner. Men sukker kan linkes til hverandre på flere ulike måter. F.eks. kan glukose-molekyler linke til andre sukkertyper på seks ulike steder. Som følge kan sukker danne forgrenede kjeder, som er mye mer sammensatte enn lineære kjeder av nukleotider eller aminosyrer.
Betrakt molekyler som inneholder bare seks underenheter: men 4 nukleotider kan linkes sammen til å danne maksimum ca. fire tusen ulike molekyler, og 22 aminosyrer kan lenkes til å danne max. ca 100 millioner ulike molekyler, så kan de dusin sukkerarter som vi vanligvis finner i levende celler, kan teoretisk danne mer enn 1 billion ulike molekyler. (31) Den informasjons-bærende kapasiteten ved glykaner overstiger altså klart de kombinerte kapasiteter til DNA og proteiner.
I glykosylasjon blir et glykan først tilsatt til et protein i løpet av, eller etter, proteinsyntesen. De komplette, enzym-nettverkene, som involverer dusinvis av interagerende proteiner, modifiserer glykaner i forhold til cellens behov. Den resulterende endringen setter cellen i stand til å tilpasse seg til en gitt omgivelse eller konfigurere den for et gitt stadium i embryo-utviklingen. Den endelige, glykosylerte formen  til et protein, er således meget lang fra den direkte spesifisering ved DNA-sekvensen. Som flere biokjemikere har uttrykt det, er endring til proteiner gjennom enzmatisk glykosylasjon "en begivenhet som strekker seg langt utover genomet." (32) Den "forsyner et tilleggsnivå av informasjonsinnehold i biologiske systemer." (33) Faktisk kan det bane vei for en slags "kvante-mekanisk revolusjon i biologien, på samme måte som den som revolusjonerte fysikken på starten av det 20. århundre." (34)
til et protein, er således meget lang fra den direkte spesifisering ved DNA-sekvensen. Som flere biokjemikere har uttrykt det, er endring til proteiner gjennom enzmatisk glykosylasjon "en begivenhet som strekker seg langt utover genomet." (32) Den "forsyner et tilleggsnivå av informasjonsinnehold i biologiske systemer." (33) Faktisk kan det bane vei for en slags "kvante-mekanisk revolusjon i biologien, på samme måte som den som revolusjonerte fysikken på starten av det 20. århundre." (34)
Så de to første stegene i det sentrale dogmet feiler: DNA spesifiserer ikke fullt ut m-RNA og m-RNA spesifiserer ikke fullt ut proteiner. Men mest avgjørende feiler det sentrale dogmet i dets tredje og avgjørende steg: proteiner spesifiserer ikke en organisme.
III. Behovet for romlig informasjon
Etter at RNA og proteiner er dannet i en elle, må mange av dem transportert til ulike lokasjoner for å fungere skikkelig. I tillegg til deres protein-kodende regioner, har noen m-RNA sekvenser som kalles 'zip-koder' som spesifiserer adresser i cellen som de skal transporteres til. (35) Lik postnr i postvesener, er imidlertid zip-koden ubrukelig uten en pre-eksisterende adresse. Celler med kjerne inneholder mikroskopiske fibre, kalt "mikrotubuler". (Nano)molekylære maskiner ferdes langs mikrotubulene, og transporterer ulik last i gjennom hele cellen.
Om en benytter postnummer metaforen, så kan molekylære maskiner sammenlignes med varebiler og mikrotubulene med et motorvei-system. Men adressene for intracellulær transport, hvordan bestemmes de? I noen tilfeller kan adressesene spesifiseres som den romlige arrangering av motorveier. Ved å benytte postnummer metaforen igjen, kan noen varebiler bli ekspedert til en spesiell motorvei, og så fraktes til enden av veien, og losset. I andre tilfeller er destinasjonen kjent å være spesifisert ved molekyler innbygd i cellemembranen. Opprinnelig trodde vitenskapsfolk at proteiner kunne flyte fritt gjennom en membran, lik båter gjennom en kanal. Men nå er det imidlertid kjent at mange membran proteiner er arrangert i ikke-tilfeldige mønstre, som kan være ganske stabile. (36)
M.a.o. inneholder biologiske membraner romlig informasjon. Den informasjonen formidles delvis ved en sukker-kode og en bio-elektrisk kode.
 A. Sukker-koden
A. Sukker-koden
Som vi så ovenfor overstiger den informasjonsbærende evne ved forgrenede glykaner mye den samme hos DNA og proteiner. Det finnes også lange ikke-forgrenede glykaner, kalt 'glyko-saminoglykaner' (GAGer) som primært inntreffer på overflaten til en celle. Selv om de ikke er forgrenede, kan GAG-er samles fra dusinvis av ulike underenheter, og sulfatgrupper kan tilknyttes dem i en vid variasjon av mønstre. Dette gjør GAGer til noen av de mest informasjonsrike molekyler i naturen. (37) Faktisk har informasjonen i forgrenede og ikke-forgrenede gykaner, blitt kalt "sukker-koden". (38)
Biolog R. Schnaar skrev i 1985 at det er "en kode på overflaten av hver celle, som spesifiserer dens funksjon og styrer samhandling med andre celler." Schnaar mistenkte at "sukker tjener som kodens alfabet". (39) Vi vet nå at han hadde rett. Overflaten av alle levende celler, studert til dags dato, er dekket med glykaner. Celle-overfalte glykaner i tidlige embryoer som ormer, bananfluer, fisk, kylling og mus endrer seg på et høyst ordnet vis, og danner mønstre som er korresponderer med ulike stadier av embryo-utviklingen. De er involvert i celle-orientering, sammentrekning, bevegelse, svar på regulerende faktorer og celle-celle kommunikasjon.
Sukkerkoden blir fortolket av proteiner som kalles 'lektiner', som gjenkjenner spesifikke tre-dimensjonale strukturer og glykaner, ved hjelp av 'karbohydrat-gjenkjennende-domener'. (40) Lektiner spesifiserer en bred variasjon av interaksjon mellom celler.
B. Den bio-elektriske koden
Cellens overflate-kode inkluderer mer enn sukker-koden. Det har lenge vært kjent at sannsynligvis alle levende celler genererer elektriske felt over sine membraner. (41) I dyre-celler flytter en natrium-kalium pumpe i membranen som frakter natrium celler ut av cella, mens den tar to kalium-ioner inn i den. Det øker det intracellulære trykket av kalium-ioner, som så flyter ut av celler gjennom ione-selektive kanaler i membranen. Den kombinerte virkningen fra natrium-kalium pumpen og kalium-'lekkasje' gjør at det indre av cellen får negativ elektrisk ladning i forhold til det ytre. Det resulterer i et endogent elektrisk felt.
Mønsteret av ione-kanaler i membranen bestemmer formene til de endogene elektriske feltene, som endres i løpet av embryo-utviklingen. Det endogene elektriske feltet i et froskeegg, driver en strøm av ioner gjennom egget. I det det befruktede egget deler seg, og cellene re-arrangerer seg for å danne et rumpetroll, endrer det elektriske feltet seg på organiserte måter. Det samme gjelder kylling-embryo. (42) I frosk, kylling og mus -embryoer, merkes fremtidige steder for lemmenes utvikling ved sterk, utgående strøm, før lemmene dukker opp der. (43)
Hvordan påvirker endogene elektriske felt embryo-utvikling? en måte er prolig ved å styre celle-bevegelser. Biologer har anvendt kunstige elektriske felt av fysiologisk styrke på embryoniske celler og observert at noen typer av celler flytter seg mot en den ene eller andre polen. Elektriske felt av fysiologisk styrke, kan også påvirke celledeling. (44) Sterke bevis for at endogene elektriske felt spiller betydelige roller i embryo-utviklingen kommer fra å kunstig ødelegge dem og så observere effektene. Å redusere en ione-strøm, assosiert med utvikling av av hale(stjert) utvikling i et kylling-embryo, resulterer i abnormaliteter. (45) Å manipulere ione-kanaler som genererer et elektrisk felt assosiert med øye-utvikling, i froske-embryoer, resulterer i deformerte eller manglende øyne, eller rumpetroll med øyne lokalisert på siden av halen. (46)
Så endogene elektriske felt er visselig involvert i embryo-utvikling. R. Shi og R. Borgens gikk gjennom det eksperimentelle bevis i 1995, og konkluderte med at at slike felt "kan forsyne et tre-dimensjonalt koordinat system" som hjelper å spesifisere form i embryoer. (47) M. Levin argumenterte at endogene elektriske felt kan fungere som "form-maler" og "det er sannsynlig at en full forståelse av [utviklingen] .. og dens informasjons-innehold, trenger å involvere å knekke den bio-elektriske koden." (48)
IV. Implikasjoner for neo-darwinismen
Så membran-mønstre bærer essensiell biologisk informasjon. Likevel kan ikke den informasjonen reduseres til sekvensinformasjonen i DNA. Selv om DNA-sekvenser fullstendig skulle spesifisere m-RNA og proteiner, så må den romlige distribusjonen av proteiner i celle-membranen spesifiseres uavhengig, lik adresser i post-metaforen. Så hva er det som spesifiserer membran-mønstre?
 A. Membran-arv
A. Membran-arv
Noen membran mønstre har maler fra membranene de stammer fra i celledelingens løp. I slike tilfeller inkorporeres proteiner fra cellens indre, gjennom membranens vekst, bare om de matcher det eksisterende avtrykket (matrix -49). Biolog R. Poyton foreslo at biologiske membraner bærer 'romlig hukommelse', der enhetene er romlig lokaliserte multi-underenhets proteiner. I det en membran vokser i forberedelse for en deling, skilles proteinene fra hverandre inn i sine underavdelinger. Nylig syntetiserte enheter i cytoplasmaet forbinder seg med eldre underenheter for å danne hybride proteiner som er kjemisk identiske med de opprinnelige proteinene, og bevarer den opprinnelige romlige informasjonen. Poyton konkluderte: "Det å innse at genetisk hukommelse er én-dimensjonal langs ett DNA-molekyl, mens romlig hukommelse sannsynligvis er to-dimensjonal langs membranens overflate, og tre-dimensjonal i cellens indre, så er det sannsynlig at romlig hukommelse er mer komplisert og mangfoldig enn genetisk hukommelse." (50) Videre forskning har funnet bevis konsistent med Poytons hypotese. (51)
Celle-overfalte maler har blitt grundig studert i encellede organismer (protoza). Noen protoza er dekket med cilia, små hår som slår rytmisk for fremdrift og ernæring. For mer enn 50 år siden oppdaget forskere at om de kunstig endret cilia-mønsteret, så kunne avkommet etter en celledeling arve det endrede mønsteret, selv om DNA var uendret. Siden da har cilia-protoza med kunstig endret mønster blitt stødig etablert i laboratorier gjennom tusener av generasjoner. (52)
St. Ng og J. Frankel studerte fenomenet og konkluderte i 1977: "Cellen som arkitekt benytter ikke bare genomisk informasjon for å produsere egnede bygnings-blokker, men arrangerer dem også i tillegg i følge tegninger som definert i pre-eksisterende arkitekturen." (53) Slike maler er ikke begrenset til protoza. I 1990 studerte M. Locke mønstre i overhud til sommerfugl-celler, og konkluderte at deres arv "avhang av mer enn antall og type av molekyl. Mønster-duplisering involverer relativ posisjon og orientering," faktorer som ikke kan spesifiseres bare gjennom en base-sekvens. (54)
Celler med kjerne inneholder mange ulike typer av membraner, som Th. Cavalier-Smith kollektivt har betegnet "membranomen". Hver membran er karakterisert ikke bare ved sin kjemi, men også med sitt  membran mønster. . Cavalier-Smith kalte membraner som oppsto ved vekst og deling av samme type for 'genetiske membraner'. Om noe av den genetiske membranen gikk tapt, kunne det sannsynligvis ikke bli gjendannet fra sine opprinnelige molekyler, selv om hele protein-kodende DNA-sekvenser var intakte, fordi den nødvendige romlige informasjonen var borte.
membran mønster. . Cavalier-Smith kalte membraner som oppsto ved vekst og deling av samme type for 'genetiske membraner'. Om noe av den genetiske membranen gikk tapt, kunne det sannsynligvis ikke bli gjendannet fra sine opprinnelige molekyler, selv om hele protein-kodende DNA-sekvenser var intakte, fordi den nødvendige romlige informasjonen var borte.
Så i følge Cavalier-Smith var ideen om at genomet inneholder all informasjon som behøves for å danne en organisme: "simpelt hen feilaktig. .. Dyrs utvikling danner en kompleks 3-dimensjonal multicellulær organisme, ikke ved å starte fra den lineære informasjon i DNA .. men alltid ved å starte med en allerede høyst kompleks tre-dimensjonal encellet organisme, det befruktede egg (55) Men membran-arv kan ikke være hele historien. I løpet av embryo-utvikling, dupliserer ikke bare membranen til celler de stammer fra; membran mønstre er meget ulike i nerveceller, muskelceller, blodceller, ben og lever -celler, bare for å nevne noen. Så membran mønstre må endres i løpet av embryo-utviklingen. Endringene er imidlertid ikke tilfeldige, de er høyst regulerte for å danne de integrerte organ-systemer til det voksne individet. Om membran mønstre ikke er spesifisert via membran-mønstre i celler de stammer fra, hvor er de så spesifisert?
B. En matematisk tilnærming
Det korte svaret er at vi ikke vet enda. Men teoretiske biologer har adressert problemet matematisk. I 1950 årene introduserte R. Rashevsky og R. Rosen en ny tilnærming for studiet av levende organismer, som de kalte "relasjonell biologi". I stedet for å gi ontologisk prioritet til molekyler, slik som DNA, gir relasjonell biologi forrang til relasjonene som konstituerer et organisert system. (56) For å gjøre tilnærmingen rigorøs, vendte Rashevsky og Rosen seg til "kategori teorien" som var utviklet i 1940-årene. En generalisering av klassisk mengde-teori, kategori teori, som var blitt utviklet i 1940-årene -kan benyttes til modellere matematisk endringene av informasjon som inntreffer i levende organismer. Men det er ikke klart enda hvorvidt relasjonell biologi og kategori teorien vil lykkes i å forklare endringer i løpet av embryo-utviklingen. Det som er klart, er at neo-darwinismen feiler i å forklare evolusjon.
C. Hvorfor neo-darwinismen feiler
I følge neo-darwinistisk teori forsyner DNA-mutasjoner råmaterialet til evolusjonen. Om det sentrale dogmet holdt mål, så kunne det være tilfelle. Men dogmet om at "DNA lager RNA som lager proteiner, som lager oss," feiler i hvert steg. Mange RNA blir modifisert til det nivået at de ikke lenger reflekterer base-sekvensen i DNA, som de ble transkribert fra. Og den endelige foldede formen til proteinet, som funksjonen avhenger av, blir i noen tilfeller ikke fullt  spesifisert av m-RNA som det blir oversatt fra. Videre blir de fleste proteiner ekstremt modifisert ved hjelp av glykosalisjon, tilføyelse av komplekse sukkerarter fra nettverk av enzymer. Så det endelige produkt av transkripsjon og oversettelse er vanligvis meget langt fra å bli spesifisert av DNA-sekvenser.
spesifisert av m-RNA som det blir oversatt fra. Videre blir de fleste proteiner ekstremt modifisert ved hjelp av glykosalisjon, tilføyelse av komplekse sukkerarter fra nettverk av enzymer. Så det endelige produkt av transkripsjon og oversettelse er vanligvis meget langt fra å bli spesifisert av DNA-sekvenser.
Ett enda mer alvorlig problem for sentraldogmet er at proteiner må bli skikkelig lokalisert i en celle for at den skal fungere. Men DNA spesifiserer ikke romlige koordinater. I stedet spesifiseres de ved arkitekturen til cellen og ved mønstre i membranen som går forut for transkripsjon og oversettelse. Så selv om DNA fullstendig spesifiserte proteinets endelige form, så måtte det enda være informasjon som var uavhengig av DNA.
Det er sant at noen DNA-mutasjoner kan være tjenlige for en organisme i en spesiell omgivelse. F.eks. forgifter antibiotikaen streptomycin tuberkuløse bakterier ved å søke ut ribosomene deres og derved blokkere protein-syntese. For DNA-mutasjoner som delvis ødelegger ribosomene kan hindre antibiotikaen fra å gjenkjenne dem. Selv om de mutante bakteriene er ødelagt i nærvær av antibiotikaen, er de bedre stilt enn de ikke-ødelagte bakteriene.
Men å ødelegge et ribosom er meget forskjellig fra å produsere tjenlige nye variasjoner i embryo-utvikling, som kunne utgjøre råmaterialet for evolusjon. Biologer har søkt systematisk etter mutasjoner som påvirker utvikling av bananfluer, rundormer, sebrafisk og mus. Effektene av slike mutasjoner aller alltid i tre kategorier. Enten klarer embryoet å komme seg over endringene og utvikler seg normalt, eller så deformeres eller dør embryoet. Dette kan knapt kalles råmaterialet for evolusjon.
Referanser:
Referanser:
9. J. Watson og Fr. Crick, "Genetical Implications of the Structure of Deoxyribonucleic Acid," Nature 171, (1953): 964-967
12. A. Weinberg, Messenger RNA: "Origin of a Discovery," Nature 414 (2001) 485
15. J. Watson og N. Hopkins et al, Molecular Biology of the Gene, 4.utg. (Menlo Park; CA: Benjamin/Cummings, 1987), 747
16. Fr. Collins, The Language of God (NY: Free Press, 2006, 2.
17. E. F. Keller, The Century of the Gene (Cambridge, MA: Harvard UP, 2000), 87
18. Judson, Eighth Day of Creation, 217
19. C.H. Waddington, "The Epigenotype," Endeavour 1 (1942); 18-20
Bilde 7. Transkripsjons-maskineri
 20. C.H. Waddington, An Introduction to modern Genetics (London: G.Allen & Unwin, 1939), 156
20. C.H. Waddington, An Introduction to modern Genetics (London: G.Allen & Unwin, 1939), 156
21. J.C. Kiefer, "Epigenetics in Development," Development Dynamics 236 (2007): 1144-1156
22. S.W. Herring, "Formation of the Vertebrate Face: Epigenetic and Functional Influences," American Zoologists 33 (1993): 472-483
24. W. Sun, X. You et al, "Ultra-Deep Profiling of Alternative Spliced Drosophila Dscam Isoforms by Circ-Ass. Multi-Segment Sequencing," EMBO Journal 32 (2013):2029-2038
25. Y. Barash, J.A. Cararco et al, "Deciphering the Splicing Code," Nature 456 (2010): 53-59
26. J. Hoon Bahn et al, "Genomic Analysis of ADAR1 Binding and Its Involvement in Multiple RNA Processing Pathways," Nature Comm. 9 (2015): 6355
28. R.B. Russell og G.J: Barton, "Structural Features Can be Unconcerved in Protein with Similar Folds," Journal om Molecular Biology 244 ( 1994):332-350
29. A.G. Murzin, "Metamorphic Proteins," Science 320 (2008): 1725-1726
30. F. U. Hartl, A. Bracher et al, "Molecular Chaperones in Protein Folding og Proteostasis," Nature 475 (2011): 324-332
31. R.A. Laine, "A Calculation of All Possible Oligosaccharide Isomers Both Branched and Linear Yields, 1.05*10^12, GlychoBiology 4 (1994): 759-767
32. R.G. Spiri, "Protein Glycosylation: NAture, Distr. Enzymatic Formation, and Disease Implications of Glycopeptide Bonds," GlychoBiology 12 (2002): 43R-56R
33. K. W. Moremen et al, "Vertebrate Protein Glococylation: Diversity, Synthesis and Function," Nature Reviews Molecular Cell Biology 123(2012): 448-462
34. Gordan Lauc et al, "Epigenetic Regulation of Glycosylation is the Quantum Mechanics of Biology," Biochimica et Biopphysica Acta 1840 (2014): 65-70
35. R.H. Singer, "RNA Zipcodes for Cytoplastmic Addresses," Current Biology 3 (1993): 719-721, doi: 10.10106/0960-9822(93)90079-4
36. Mercer et al, "Long Non-coding RNAs"
38. Johnny T.Y. Kung et al, "Long Non-coding RNAs. Past, Present, and Future," Genetics 193 (2013): 651-669
40. Perdomo-Sebogal, "Gene Regulation Factors."
41. M.J. Hubisch et al, "Exploring the Genesis and Functions of Human Accelerated Region Shed Light on Their Role in Human Evolution," Current Opinion in Genetics and Development 29 (2014): 15-21.
 44. M. Fontenot et al, "Molecular Networks and the Evolution of Human Cognitive Specializations," ," Current Opinion in Genetics and Development 29 (2014): 52-59
44. M. Fontenot et al, "Molecular Networks and the Evolution of Human Cognitive Specializations," ," Current Opinion in Genetics and Development 29 (2014): 52-59
45. Oldham et al, "Conservation and Evolution of Gene Coexpression Networks in Human and Chimpanzee Brains, " 17973-17978.
46. R. Sternberg and J. A. Shaphiro, "How Repeated Retroelements Format Genome Function," Cytogenetic and Genome Research, 110 (2005): 108-116.
48. D. Bramble et al, "Endurance Running and the Evolution of Homo," Nature 432 (2004): 345-352
49. N. T. Roach et al, "Elastic Energy Storage in the Shoulder and the Evolution of High-Speed Throwing in Homo," Nature 498 (203): 483-487
50. Varki and Altheide, "Comparing the Human and Chimpanzee Genome."
54. D. Bramble and Lieberman, "Endurance Running
55. Vaski et al, "Explaining Human Uniqueness."
56. J.B. Verrengia, "Scientists Debate Suggestion Jaw Mutation Led to Evolution," Ass. Press. USA Today, March 24, 2004.
64. Balakierev and Ayala, "Pseudogenes: Are they 'Junk'?"
65. Y. Z. Wen et al., "Pseudogenes Are Not Pseudo Any More," RNA BIology 9, no.1 (Jan. 2012): 27-32
66. D. Zheng and M.B. Gerstein, "The Ambigious Boundary between Genes and Pesudogenes: The Dead Rise Up, or Do They?" Trends in Genetics 23 (2007): 219-224.
67. Y. Z. Wen et al., "Pseudogenes Are Not Pseudo Any More,"
68.A. Molerinho et al, "Evolutionary Constraints in the beta-Globin Cluster: The Signature of Puryfying Selection at the delta-GLobin (HBD) Locus and Its Role in Dev. Gene Regulation," Genome Biology and Evolution 5 (2013):559-571
69. St. A. Hoang et al, "The Network Architecture of the Sacharromyces cerevsiae Genome," Plos One 8 (2013): e81972
70. C.D.M. Rodley et al, "Global Identification of Yeast Chromosome Interactions Using Genome Confor mation Capture," Fungal Genetics and Biology 46 (2009): 879-886
71. A.B. Stergasis et al, "Exonic Transcription Factor Binding Directs Codon Choice And Affects Protein Evolution," Science 342 (2013):1367-1372
72. F. Zhang et al, "Differential Arginylation of Actin Isoforms Is Regulated by coding Sequence-Dependent Degradiation,2 Science 329 (2010):1534-1537.
73. Y. Fan et al, "GEnomic Structure and Evolution of the Ancestral Chromosome Fusion Site in 2q13-2q14.1 and Paralogous Regions on Other Human Chromosomes," Genome Research 12 (2002):1651-1662.
74. A. Gauger et al, Science and Human Origins (Seattle, Discovery Institute Press, 2012)
76. R. Dawkins, The God Delusion (New York: Random House, 2009).
Ansvarlig for oversettelse og bilder ved Asbjørn E. Lund


 sekvenser kan bli overført fra DNA til protein, men ikke tilbake igjen. --Senere kalt for sentraldogmet i molekylær biologi.
sekvenser kan bli overført fra DNA til protein, men ikke tilbake igjen. --Senere kalt for sentraldogmet i molekylær biologi.  tidligere hadde Waddington benyttet termen 'epigenotype' for mer bredt å referere til "settet av organisatører og organiserende relasjoner som et spesifikt vevstykke vil bli gjenstand for, gjennom sin utvikling." (20) Så epigenetikk har hatt ulike betydninger siden starten. I en snever betydning referer det til mekanismene som DNA produserer fenotype effekter gjennom. I en bredere betydning, refererer det til alle faktorer involvert i utviklingen, der DNA er én.
tidligere hadde Waddington benyttet termen 'epigenotype' for mer bredt å referere til "settet av organisatører og organiserende relasjoner som et spesifikt vevstykke vil bli gjenstand for, gjennom sin utvikling." (20) Så epigenetikk har hatt ulike betydninger siden starten. I en snever betydning referer det til mekanismene som DNA produserer fenotype effekter gjennom. I en bredere betydning, refererer det til alle faktorer involvert i utviklingen, der DNA er én.
 B. m-RNA spesifiserer ikke endelig form for mange proteiner
B. m-RNA spesifiserer ikke endelig form for mange proteiner til et protein, er således meget lang fra den direkte spesifisering ved DNA-sekvensen. Som flere biokjemikere har uttrykt det, er endring til proteiner gjennom enzmatisk glykosylasjon "en begivenhet som strekker seg langt utover genomet." (32) Den "forsyner et tilleggsnivå av informasjonsinnehold i biologiske systemer." (33) Faktisk kan det bane vei for en slags "kvante-mekanisk revolusjon i biologien, på samme måte som den som revolusjonerte fysikken på starten av det 20. århundre." (34)
til et protein, er således meget lang fra den direkte spesifisering ved DNA-sekvensen. Som flere biokjemikere har uttrykt det, er endring til proteiner gjennom enzmatisk glykosylasjon "en begivenhet som strekker seg langt utover genomet." (32) Den "forsyner et tilleggsnivå av informasjonsinnehold i biologiske systemer." (33) Faktisk kan det bane vei for en slags "kvante-mekanisk revolusjon i biologien, på samme måte som den som revolusjonerte fysikken på starten av det 20. århundre." (34)  A. Sukker-koden
A. Sukker-koden A. Membran-arv
A. Membran-arv membran mønster. . Cavalier-Smith kalte membraner som oppsto ved vekst og deling av samme type for 'genetiske membraner'. Om noe av den genetiske membranen gikk tapt, kunne det sannsynligvis ikke bli gjendannet fra sine opprinnelige molekyler, selv om hele protein-kodende DNA-sekvenser var intakte, fordi den nødvendige romlige informasjonen var borte.
membran mønster. . Cavalier-Smith kalte membraner som oppsto ved vekst og deling av samme type for 'genetiske membraner'. Om noe av den genetiske membranen gikk tapt, kunne det sannsynligvis ikke bli gjendannet fra sine opprinnelige molekyler, selv om hele protein-kodende DNA-sekvenser var intakte, fordi den nødvendige romlige informasjonen var borte. spesifisert av m-RNA som det blir oversatt fra. Videre blir de fleste proteiner ekstremt modifisert ved hjelp av glykosalisjon, tilføyelse av komplekse sukkerarter fra nettverk av enzymer. Så det endelige produkt av transkripsjon og oversettelse er vanligvis meget langt fra å bli spesifisert av DNA-sekvenser.
spesifisert av m-RNA som det blir oversatt fra. Videre blir de fleste proteiner ekstremt modifisert ved hjelp av glykosalisjon, tilføyelse av komplekse sukkerarter fra nettverk av enzymer. Så det endelige produkt av transkripsjon og oversettelse er vanligvis meget langt fra å bli spesifisert av DNA-sekvenser. 20. C.H. Waddington, An Introduction to modern Genetics (London: G.Allen & Unwin, 1939), 156
20. C.H. Waddington, An Introduction to modern Genetics (London: G.Allen & Unwin, 1939), 156